
STRUTTURA ATOMICA,ELETTRONI & RIEMPIMENTO ELETTRONICO

by nicole cum
Artwork: Nicole Cum 2CGC
- Joined Jan 2019
- Published Books 1
Copyright © 2019
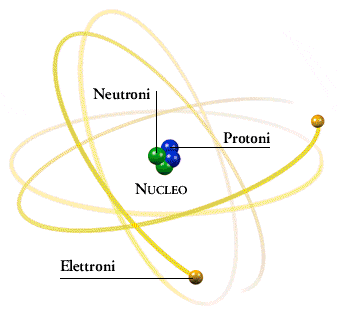
L’ atomo è la particella più piccola della molecola.
Ogni atomo è formato da 3 particelle subatomiche:
i protoni sono particelle subatomiche di massa pari ad 1a e aventi carica elettrica POSITIVA ;
i neutroni sono particelle subatomiche di massa pari ad 1 e sono PRIVI di carica elettrica;
gli elettroni sono particelle subatomiche di massa pari ad 1/2000 uma = 0,0005 uma aventi carica elettrica NEGATIVA.
La carica è una proprietà della materia che origina le forze di attrazione o repulsione.
Gli isotopi sono atomi dello stesso elemento chimico ma con diversa massa atomica.
Il principio di indeterminazione di Heisenberg afferma che è impossibile conoscere nello stesso istante la posizione e la velocità di un elettrone. Di conseguenza è impossibile tracciare l’orbita di un elettrone.
La fisica quantistica ha deciso di trovare la zona dello spazio intorno al dove trovare l’elettrone (orbitale).

L ‘ orbitale è la zona dello spazio attorno al motore dove si trova la possibilità di trovare l’elettrone.
L’orbitale è previsto da 3 proprietà:
1_ la dimensione
2_ la forma
3_ l’orientamento nello spazio (le direzioni possibili)
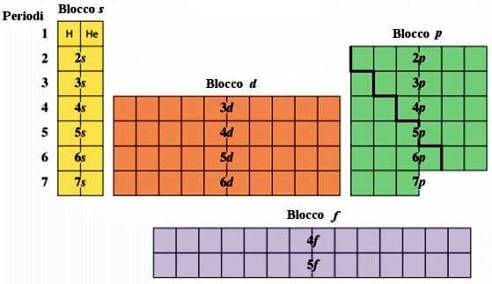
La dimensione viene indicata con il numero quantico che va da 1 a 7.
Il numero quantico “indica il livello energetico dell’elettrone.
La forma può essere di 4 tipi:
la forma “s” ovvero sferica;
la forma “p” ovvero a papillon;
la forma “d” ovvero a doppio papillon;
la forma “f”.
Fissata la dimensione di un’orbitale non sono sempre disponibili tutte le forme per esempio:
n = 1__forme possibili “s”
n = 2__forme possibili “sp”
n = 3__forme possible “spd”
n> 4__forme possibili “spdf”.
Esistono solo 7 orbitali sferici; la forma “p” ha 3 ipotesi possibile (-1; 0; 1); la forma “d” ha 5 orizzonte (-2; -1; 0; 1; 2);
la forma “f” ha 7 ipotesi possibile (-3; -2; -1; 0; 1; 2; 3).
Il principio di esclusione di Pauli afferma che in un’orbitale può essere massimo 2 elettroni con spin opposto.

L’elettrone si posiziona nell’orbitale libero a più bassa energia.
La Regola dell’ottetto afferma Che Gli Elementi della tavola periodica tenderanno ad Essere il Loro ultimo Livello energetico La CONFIGURAZIONE s2; 2P6. per farlo cederanno o acquisteranno elettroni ad altri elementi.
Gli elementi possono quindi essere classificati in base alle loro tendenze in:
– Metalli: Elementi che tendono a cedere elettroni (sulla sx della tavola periodica);
– Non Metalli: Elementi che tendono ad acquistare (sulla dx della tavola periodica).
L’elemento che cede elettroni subisce un’OSSIDAZIONE e quindi si ossida; l’elemento che acquista elettroni subisce una RIDUZIONE e quindi si riduce.
L’elettronegatività è una misura della forza con cui è un motore di fronte agli elettroni più esterni di un altro atomo.
NON METALLI hanno alta elettronegatività mentre i METALLI hanno bassa elettronegatività.
L’elettronegatività aumenta da sx verso dx e dal basso verso l’alto.
si avrà una reazione in forma IONICA quando l’elettronegatività> 1,7; mentre si accende una reazione in forma MOLECOLARE quando l’elettronegatività <1,7.
Published: Jan 29, 2019
Latest Revision: Jan 30, 2019
Ourboox Unique Identifier: OB-564515
Copyright © 2019







